
Потеря зрения по наследству: что важно знать о врожденном амаврозе Лебера
21.12.2021
Какие процессы отвечают за нашу способность видеть и как устроен «ген зрения»? Из-за чего возникает болезнь, при которой зрение полностью падает еще в детстве, и по каким признакам можно ее определить? Как живут люди, которым слепота передалась по наследству, и чем медицина может им помочь?
Вместе с информационно-просветительским гуманитарным проектом «12 месяцев» мы продолжаем серию материалов о редких (орфанных) генетических заболеваниях и жизни людей с ними.
Читайте в декабре рассказ о врожденном амаврозе (слепоте) Лебера, который встречается у одного из 33 тысяч человек, а также историю пациента — педагога и радиоведущей Цындымы Бойко.
Что такое врожденный амавроз Лебера и как проявляется это заболевание?
Врожденный амавроз Лебера — это тяжелое наследственное заболевание сетчатки, которое приводит к сильному ухудшению зрения и слепоте. Оно встречается у одного человека из 33 тысяч во всем мире.
Уже на первом году жизни ребенка родители замечают, что младенец не фиксирует взгляд, а его зрачок не реагирует на свет. Среди других симптомов — неконтролируемые ритмичные движения глазных яблок (нистагм), постоянное надавливание на глаза и трение глаз костяшками пальцев (симптом Франческетти).
Полная потеря зрения, как правило, наступает к 10 годам или подростковому возрасту.
Врожденный амавроз или слепота (от греческого слова amauros — «темный, слепой») Лебера — это генетическое заболевание, то есть его причина — неправильная работа генов. Оно составляет более 5% от всех унаследованных заболеваний сетчатки: известно, что с ним родились около 20% слепых детей, обучающихся в специализированных образовательных учреждениях.
Как наука узнала, что потеря зрения передается по наследству?
В 1869 году немецкий офтальмолог Теодор Лебер впервые выявил необычную и тяжелую форму потери зрения у ребенка. Чуть позже, наблюдая за детьми в школе для незрячих, он заметил, что заболевание имеет «кровное родство» — так появилась его статья, в которой врач рассуждал о том, что слепота передается по наследству.
Предположения Лебера впоследствии подтвердились, а описанные им случаи атрофии зрительных нервов разошлись на два самостоятельных заболевания — с разными генетическими причинами возникновения, типом наследования, клиническими проявлениями и методами лечения. Это — наследственная оптическая нейропатия Лебера (Leber hereditary optic neuropathy, LHON) и амавроз зрительного нерва Лебера (Leber congenital amaurosis, LCA).
В 1957 году шведский психиатр Карл-Генри Альстрём предположил, что описанная Лебером слепота наследуется аутосомно-рецессивно.
То есть ген с ошибкой унаследован от обоих родителей, и половая принадлежность здесь не при чем — этот ген расположен не в половых хромосомах (не в X, и не в У). Просто мужчина и женщина оказались его носителями, причем клинические признаки заболевания у них, вероятно, отсутствовали.
Риск, что ребенок такой пары родится с наследственным заболеванием, например, амаврозом Лебера, составляет 25%.
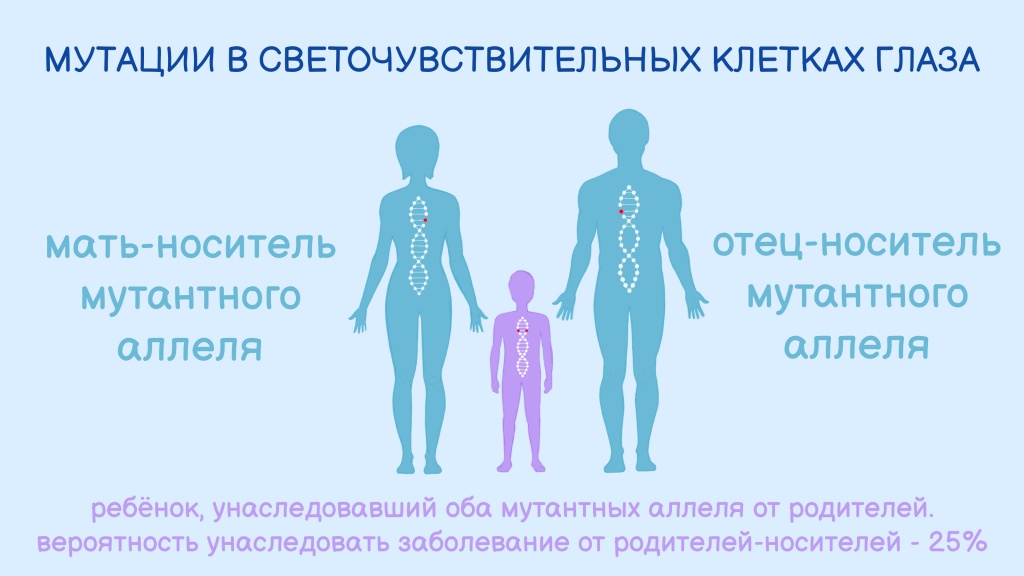
Схема аутосомно-рецессивного типа наследования врожденного амавроза Лебера
Врожденный амавроз Лебера — это группа заболеваний?
На сегодняшний день известно как минимум 400 мутаций в 25 генах, приводящих к врожденому амаврозу Лебера. Эти генетические ошибки обнаруживаются у 70-80% пациентов — у части пациентов с клинической картиной и офтальмологическими признаками этого заболевания так и не удается найти мутацию.
Выделяют 19 типов амавроза Лебера — по типу обнаруженной мутации. Каждому типу присваиваются порядковые номера — от LCA1 до LCA19. Наиболее распространенный (5-10% всех случаев), хорошо изученный с молекулярной точки зрения и имеющий генетическую терапию — это второй тип — LCA2. При этом типе происходит мутация в гене RPE65.
Как ошибки в гене влияют на зрение?
Основной механизм возникновения заболевания можно объяснить тем, что в особых светочувствительных клетках глаза — палочках и колбочках, которые преобразуют световой импульс в нервный сигнал, воспринимаемый головным мозгом, происходит нарушение зрительного цикла. При мутациях эти светочувствительные клетки погибают и перестают преобразовать сигнал, что ведет к прогрессирующей потере зрения.
Лучше всего такой патогенетический механизм изучен при мутации в гене RPE65. При этой мутации есть дефицит или полностью отсутствует фермент, который поддерживает зрительный цикл.
Без фермента разрывается цепочка последовательных химических реакций, необходимых для перевода светового импульса в «зрительную картинку», и чем меньше этого фермента, тем хуже становится зрение.

Можно ли вылечить врожденную слепоту?
Современная диагностика врожденного амавроза Лебера основана на стандартных офтальмологических методах обследования — это клинический осмотр, визометрия, авторефрактометрия. Также необходимы специальные методы — электрофизиологическое исследование, исследование полей зрения и применение оптической когеретной томографии.
Также врачу необходимо собрать подробный анамнез, узнать семейную историю заболевания и провести генетическое тестирование. Зачем оно нужно?
Знание точной мутации может кардинально изменить лечение амавроза Лебера, ведь это одно из немногих «редких» заболеваний, для которого разработана генная терапия. То есть неправильно работающий ген, из-за которого возникло заболевание, можно исправить.
Генная терапия — это единственный метод лечения, который влияет на причину заболевания. До ее появления все лечение сводилось к поддерживающим методам — применению витаминов и препаратов, влияющих на кровоснабжение глаз, но они лишь слегка замедляли неизбежное — потерю зрения.
Почему же глаза идеально подходят для генной терапии? Все дело в особенностях строения и расположения глаза. Так:
- глаза — легкодоступный орган для проведения манипуляций, в отличие от, например, печени или мышц;
- исправить ген нужно в сравнительно небольшом количестве клеток;
- гемато-ретинальный барьер (особая структура, которая предотвращает проникновение лишних веществ в ткань сетчатки) позволяет ограничить распространение генной терапии вне глаза и снизить вероятность иммунного ответа, который может возникнуть из-за лечения.
Как работает первый и единственный препарат против поломки гена, ответственного за слепоту?
Как работает Люкстурна? Под сетчатку каждого глаза проводится инъекция нормальной «рабочей» копии гена RPE65. Эта манипуляция позволяет доставить нужный ген непосредственно в клетки сетчатки глаза. Для такой доставки используется специальный курьер — природный адено-ассоциированный вирус, его называют вектором (Adeno-associated dependoparvovirus, AAV). Доставленный ген начинает производить фермент, необходимый для зрительного цикла.
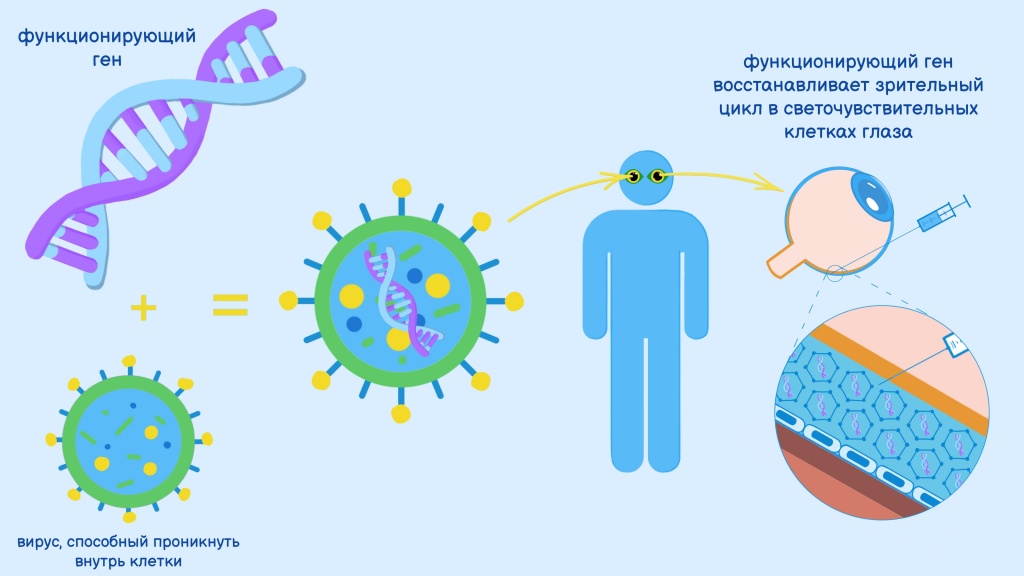
Схема генной терапии

Всем ли подойдет генная терапия?
Обязательное условие для терапии — это сохранность фоторецепторов (светочувствительных клеток), так как Люкстурна не может заново «построить» новые палочки и колбочки — препарат может только поддерживать зрительный цикл в сохранившихся клетках. Есть и побочные эффекты — боль и отечность глаз, катаракта и повышение внутриглазного давления.
Один из участников клинических исследований — старшеклассник Кристиан Гуардино — так описывал свое состояние после лечения: «Моя жизнь намного улучшилась», а его мать Бет Гуардино дополнила: «Теперь он может выходить на улицу в сумерки, чего не мог раньше, и он впервые увидел звезды. И он может читать мое выражение лица и знать, счастлива я или нет».
Идут разработки и клинические исследования и других препаратов, которые пытаются исправить мутации не только в гене RPE65, но и остальных — например, в гене фоторецептора CEP290.
На портале представлена информация о заболеваниях, возможностях их диагностики и терапии, устройстве быта и вспомогательных средствах, которые могут облегчить жизнь слабовидящим людям.






Все собранные средства идут на оплату экспертов, задействованных в консультациях, и на работу сервиса. Поддерживая системные проекты - образование талантливых врачей, просвещение широкой аудитории, внедрение технологий скрининга рака, - вы можете внести вклад в спасение сотен и тысяч людей в России и обеспечить помощь себе и своим близким, если в ней возникнет необходимость.